Реферат: Особливості застосування антибіотиків у сучасних умовах та засади раціональної антибіотико терапії
Не зменшують своїх позицій в Україні і аміноглікозиди — бактерицидні антибіотики, дія яких пов’язана з пригніченням синтезу внутришньоклітинного білка рібосомами бактерій. Існує три генерації аміноглікозидів (табл. 2).
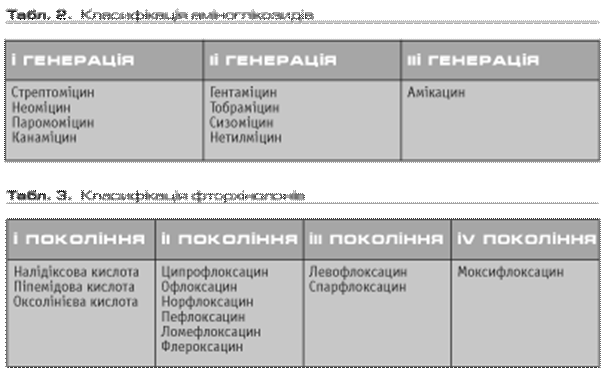
Ця група антибактеріальних препаратів активна переважно щодо аеробної грам(–) флори сімейства Enterobacteriaceae, причому до амікацину можуть бути чутливими багато штамів стафілококів, стійких до аміноглікозидів інших генерацій. Як правило, анаероби резистентні. Стрептоміцин та канаміцин активні щодо мікобактерій туберкульозу, а гентаміцин, тобраміцин, нетилміцин та амікацин — щодо Pseudomonas aeruginosa. Враховуючи стійкість пневмококів до аміноглікозидів, останні (у тому числі гентаміцин) не слід застосовувати для лікування позагоспітальної пневмонії. Треба враховувати, що активність аміноглікозидів знижується в умовах гіпоксії та ацидозу.
Антибіотики цієї групи практично не всмоктуються у ШКТ, однак за умов запальних захворювань травного тракту ймовірність абсорбції збільшується. Призначаючи аміноглікозиди, слід пам’ятати, що вони погано проникають у бронхо-легеневий секрет, ліквор, жовч та виводяться нирками, не метаболізуючись. Тому при нирковій недостатності можлива кумуляція препаратів, що потребує корекції доз.
Сумно відомими є тяжкі побічні ефекти аміноглікозидів — нефро- та ототоксичність, що частіше зустрічаються у дітей, осіб похилого віку та при вихідному порушенні функції нирок та слуху. Крім того, ці препарати можуть зменшувати нервово-м’язову передачу, отже, не повинні призначатися хворим на міастенію; небезпечним є їх використання на фоні і після введення міорелаксантів.
Найбільш популярним серед аміноглікозидів і тепер залишається гентаміцин, однак за останні 7 років його активність щодо грам(–) бактерій знизилася удвічі. Особливо це стосується захворювань сечостатевої системи. Взагалі ж, аміноглікозиди застосовуються при різноманітних інфекціях, у тому числі нозокоміальних, спричинених аеробною грам(–) мікрофлорою; а при підозрі на змішану етіологію — у поєднанні з b-лактамами та антианаеробними препаратами (метронідазолом, лінкозамідами). Гентаміцин доцільно використовувати також при бактеріальному ендокардиті (у комбінації з пеніциліном або ампіциліном). У всіх випадках розрахунок дози має проводитися з урахуванням маси тіла та віку пацієнта, функції нирок, локалізації та тяжкості інфекції.
Останнім часом все більшої популярності набувають антибіотики макролідного ряду. Така тенденція має кілька пояснень. Тривалий період найбільш уживаним у нашій країні залишався еритроміцин, який і був прототипом усіх природних та напівсинтетичних антибіотиків цього класу. Однак поява значної кількості еритроміцинрезистентних штамів пневмокока та необхідність внутрішньовенного введення препарату викликає зараз негативні нарікання на його адресу. Проте збільшення в останні роки етіологічної ролі внутрішньоклітинних патогенів, зростання їх резистентності до пеніцилінів та цефалоспоринів знов вивело препарати макролідного ряду на перші позиції, і зараз спостерігається відродження цієї групи у лікуванні інфекційно-запальних захворювань.
Макроліди поділяються на природні (першої генерації) — еритроміцин та напівсинтетичні (другої генерації) — кларитроміцин, спіроміцин, диритроміцин, азітроміцин, рокситроміцин, мідекаміцин тощо. Крім того, сучасні класифікації макролідів базуються на розмірах лактонного кільця та положенні замінників його вуглеводневих атомів. За цими показниками макроліди поділяють на 14-членні, 15-членні (азаліди) та 16-членні сполуки. Спектр дії макролідів подібний до дії бензилпеніциліну, тому вони використовуються за наявності алергії до останнього.
Поряд із відомими макролідами (еритроміцин, олеандоміцин) усе більшої ролі набувають макроліди нової генерації, що в останні роки складають ефективну альтернативу пеніцилінам та цефалоспоринам. Сучасні макроліди активні не лише проти збудників типової пневмонії (Streptococcus pneumoniae, Hemophilus influenzae), але і щодо збудників атипової пневмонії (Mycoplasma, Chlamidia, Legionella). Особливістю фармакокінетики цієї групи антибіотиків є здатність накопичуватись у тканинах (зокрема, паренхімі легень, слизовій бронхів тощо), трахеобронхіальному секреті. При цьому створюються високі концентрації препаратів в альвеолярних макрофагах та нейтрофілах. Безпечність макролідів нової генерації робить можливим їх застосування при алергії до бета-лактамів, а також у хворих, які приймають серцеві глікозиди та теофілін, оскільки, на відміну від еритроміцину, вони не змінюють концентрацію останніх у крові. Майже всі нові макроліди характеризуються низьким рівнем накопичення у кров’яному руслі. Винятком є лише рокситроміцин, що робить його препаратом вибору при лікуванні захворювань легень, які супроводжуються бактеріємією.
Ступінь проникнення антибіотиків у клітину вважається основною властивістю при лікуванні інфекцій із внутрішньоклітинною локалізацією збудника. Серед відомих на сьогоднішній день антибіотиків тільки макроліди та фторхінолони створюють у клітинах терапевтично високі концентрації. Здатність макролідів модифікувати функції макрофагів та нейтрофілів, а також їх антиоксидантні та протизапальні властивості знайшли застосування у так званих “небактеріальних” сферах, зокрема кардіології, ревматології.
Інша велика група антибіотиків, що на сьогодні стрімко виходить на провідні позиції, — це препарати фторхінолонового ряду. Фторхінолони — високоактивні синтетичні хіміотерапевтичні засоби широкого спектра дії. Нефторовані препарати класу хінолонів (нітроксолін, налідіксова кислота, оксолінієва кислота тощо) застосовуються в клініці з початку 60-х років, проте вони мають обмежений спектр дії (переважно щодо Enterobacteriacea), низьку біодоступність та призначаються для лікування неускладнених інфекцій сечовивідних шляхів та кишечника. Принципово нові сполуки вдалося отримати шляхом введення атома фтору у шосте положення молекули хіноліна. Наявність атома фтору (одного або декількох) визначає особливості антибактеріальної активності та фармакокінетичні властивості препаратів.
Хінолони поділяють на 4 генерації: нефторовані (І покоління) та фторхінолони (ІІ–IV покоління), основні представники яких представлені у таблиці 3.
Які ж саме властивості фторхінолонів дозволили їм надійно увійти до складу найбільш розповсюджених антибактеріальних засобів? По-перше, це унікальний серед антимікробних препаратів механізм дії — інгібування фермента бактеріальної клітини ДНК-гідрази та високий ступінь бактерицидної активності. По-друге, це широкий спектр антимікробної дії, який включає грам(–) та грам(+) аеробні бактерії (окремі препарати активні також щодо анаеробів), мікобактерії, хламідії, мікоплазми. Дуже важливим є факт невисокої частоти розвитку резистентності до фторхінолонів. Характерними для їх дії є позитивні особливості фармакокінетики (висока біодоступність, відмінне тканинне проникнення, пролонгована дія у більшості представників класу), відносно низька токсичність, добра переносимість та висока ефективність. Цитокінетичні властивості фторхінолонів та здатність проникати всередину клітини обумовлюють їх ефективність при хламідійній, микоплазмовій інфекції, мікобактеріозах тощо.
У багатьох клінічних котрольованих дослідженнях була показана висока ефективність цієї групи антибіотиків при інфекціях як госпітального, так і позалікарняного походження. Проте, препарати ІІ покоління доцільно застосовувати переважно при госпітальних інфекціях. Їх призначення при позагоспітальних інфекційних ураженнях дихальних шляхів обмежене внаслідок невисокої активності щодо головного збудника — S. pneumoniae.
На сьогодні найбільш дослідженими препаратами є ципрофлоксацин та офлоксацин, що застосовуються у клінічній практиці з 80-х років. Ципрофлоксацин діє на переважну більшість грам(–) та окремі грам(+) мікроорганізми. Серед грам(+) флори найбільш чутливі до нього стафілококи (крім метицилінрезистентних S. aureus). Він має досить високу активність щодо P. aeruginosa, подібну до найактивніших щодо цього мікроорганізма препаратів — цефтазидіму та меропенему. Наявність у ципрофлоксацида, а також офлоксацину та пефлоксацину двох лікарських форм дозволяє проводити “ступінчасту” терапію. При цьому слід пам’ятати, що у зв’язку з високою біодоступністю офлоксацину та пефлоксацину, дози цих препаратів при внутрішньовенному та пероральному застосуванні однакові. У ципрофлоксацину біодоступність нижча, тому при переході з парентерального введення та внутрішній прийом з метою підтримання терапевтичних концентрацій дозу слід збільшити приблизно вдвічі.
Препарати ІІІ та IV поколінь фторхінолонів характеризуються більш високою активністю щодо грам(+) мікроорганізмів і, перш за все, S. pneumoniae (грепафлоксацин, спарфлоксацин, гатифлоксацин), тому вони можуть призначатися при позалікарняних інфекціях дихальних шляхів. Висока активність цих препаратів щодо основних збудників урогенітальних інфекцій (гонорея, хламідіоз, мікоплазмоз) дозволяє з високою ефективністю застосовувати їх при захворюваннях, що передаються статевим шляхом. Окремі фторхінолони ІІІ та IV поколінь (тровафлоксацин, моксифлоксацин та клінафлоксацин), маючи широкий спектр дії, впливають також на анаеробну флору та метицилінрезистентні стафілококи. Враховуючи це, зазначені препарати у перспективі можуть стати засобами вибору для емпіричної терапії найбільш тяжких інфекцій — позагоспітальної пневмонії з тяжким перебігом, сепсису, змішаних аеробно-анаеробних інтраабдомінальних та ранових інфекцій, а також інфекцій у хворих із лихоманкою та нейтропенією.
Однак слід пам’ятати, і це зазначено в сучасних Американських та Європейських рекомендаціях з лікування позагоспітальних інфекцій нижніх дихальних шляхів, що фторхінолони, навіть з антипневмококовою активністю, мають призначатися лише пацієнтам групи ризику, а не для емпіричної терапії у всіх хворих на бронхіт або пневмонію. У протилежному випадку можливий розвиток стійкості до антибіотиків реанімаційного резерву уже на рівні дільничої ланки медичної допомоги.
При призначенні фторхінолонів необхідно враховувати можливість їх фармакокінетичної взаємодії з іншими лікарськими засобами. Перш за все, цей ризик існує при пероральному прийомі препаратів. Такі засоби, як антациди, сукральфат, солі вісмута, кальцію, препарати заліза зменшують доступність фторхінолонів, що може призвести до зниження ефективності останніх. Деякі фторхінолони викликають підвищення концентрації теофіліна в крові, що характерно для ципрофлоксацину. Водночас офлоксацин, левофлоксацин, норфлоксацин не змінюють фармакокінетику теофіліна. Виявлені у процесі терапії фторхінолонами небажані реакції у вигляді підвищення активності печінкових ферментів, шлунково-кишкових розладів, нейротоксичності, фототоксичності з’являються не часто, є зворотними та, як правило, зникають після відміни препаратів.