Реферат: Особливості застосування антибіотиків у сучасних умовах та засади раціональної антибіотико терапії
В окремих випадках із тривалістю протимікробної терапії пов’язане ще одне питання, і виникає воно, як не дивно, при успішному лікуванні. Трапляється, що лікар не наважується на 10-у добу відмінити антибіотик внаслідок залишкових явищ інфекції. Чи слід змінювати препарат, який вже вводився 10 днів, чи довести лікування до одужання тим самим засобом?
У відповідь на це питання в науковій літературі існують розрахунки динаміки розповсюдження субпопуляцій резистентних штамів збудників, якими і треба користуватись у даному випадку. Проте слід зазначити, що інколи терапія може бути подовжена тим самим препаратом до 12–14 днів без будь-яких негативних наслідків. Необхідно лише пам’ятати, що подібне подовження лікування (понад 10 діб) не є бажаним для рифампіцину, стрептоміцину та лінкозамінів (лінкоміцин, кліндаміцин), оскільки до даних препаратів мікроорганізми набувають стійкості шляхом одноступеневих мутацій.
Розглядаючи питання раціонального застосування антибактеріальних препаратів, доцільно зупинитися на характеристиці окремих, найбільш уживаних та перспективних на сьогоднішній день груп засобів. При порівнянні антибіотиків, що використовуються в Україні та світі, можна зазначити низку відмінностей. У нашій країні зберігає свої позиції традиційне лікування пеніцилінами, що займають майже третину всього продажу антибіотиків — 36 %. Після них на українському ринку йдуть аміноглікозиди та сульфаніламіди (разом з триметопримом) — по 15 %. І тільки близько 7–8 % припадає на цефалоспорини, макроліди, тетрацикліни. Останнім часом як на Заході, так і в Україні стрімко зростає об’єм використання фторхінолонів та фунгіцидних засобів. Характерною особливістю останнього десятиріччя є зменшення в антибактеріальній терапії частки тетрациклінів (4,8 %), але в Україні вони залишаються досить популярними препаратами.
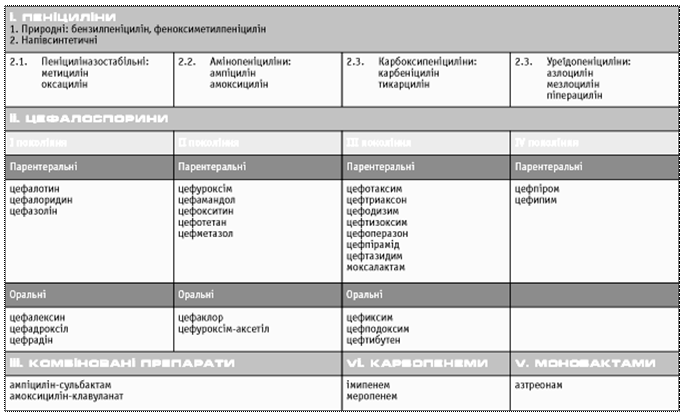
Як відомо, основу сучасної хіміотерапії складають бета-лактамні антибіотики (пеніциліни, цефалоспорини, карбапенеми та монобактами), які мають бактерицидний ефект завдяки порушенню утворення клітинної стінки. За кількістю наявних препаратів це найбільш численна група серед усіх антибактеріальних засобів. Основою класифікації сучасних бета-лактамів є їх хімічна структура (табл. 1).
Класифікація сучасних бета-лактамі.
 Природні пеніциліни є препаратами вибору при лікуванні стрептококової, пневмококової, менінгококової і гонококової інфекцій. За останні роки відмічається збільшення частоти резистентних штамів пневмококів і гонококів до бензилпеніциліну, через що в емпіричній терапії захворювань, які викликаються цими збудниками, рекомендовані цефалоспорини ІІІ покоління, макроліди.
Природні пеніциліни є препаратами вибору при лікуванні стрептококової, пневмококової, менінгококової і гонококової інфекцій. За останні роки відмічається збільшення частоти резистентних штамів пневмококів і гонококів до бензилпеніциліну, через що в емпіричній терапії захворювань, які викликаються цими збудниками, рекомендовані цефалоспорини ІІІ покоління, макроліди.
Слід нагадати, що бензилпеніцилін випускається у вигляді натрієвої та калієвої солей для парентерального введення (антибіотик при внутрішньому застосуванні руйнується кислотою шлункового соку). Калієва сіль бензилпеніциліна містить велику кількість калію (1,7 мекв в 1 млн ОД), через що великі дози цієї форми не бажані у хворих з нирковою недостатністю. Бензилпеніцилін швидко виводиться з організму, у зв’язку з чим потребує частого введення (від 4 до 6 разів на добу залежно від тяжкості інфекції). Великі його дози (20–30 млн ОД на добу) застосовуються при лікуванні тяжких інфекцій, зокрема менінгіту, інфекційного ендокардиту, газової гангрени. Середні дози препарату (10–18 млн ОД на добу) призначаються при лікуванні аспіраційної пневмонії або абсцесу легень, викликаних стрептококами групи А чи анаеробними коками, а також у комбінації з аміноглікозидами при лікуванні ентерококової інфекції (ендокардит). Малі дози бензилпеніциліну (4–8 млн ОД на добу) застосовуються при лікуванні пневмококової пневмонії. Не рекомендовано призначати бензилпеніцилін у дозах понад 30 млн ОД через ризик розвитку токсичних проявів з боку центральної нервової системи (судоми).
Пролонговані препарати пеніциліну (бензатинпеніцилін або біцилін) застосовуються для профілактики ревматизму і лікування сифілісу. Феноксиметилпеніцилін не руйнується соляною кислотою шлунка, тому його можна призначати внутрішньо та застосовувати в амбулаторній практиці, як правило — у дітей при лікуванні легких інфекцій верхніх дихальних щляхів (тонзиліт, фарингіт), порожнини рота і пневмококової пневмонії.
Спектр антимікробної дії пеніциліназостабільних пеніцилінів подібний до природніх пеніцилінів, хоча дещо поступається їм в антимікробній активності. Єдиною їх перевагою є стабільність щодо стафілококових бета-лактамаз, у звязку з чим ці напівсинтетичні пеніциліни є препаратами вибору при лікуванні доведеної або передбачуваної стафілококової інфекції (шкіри і м’яких тканин, кісток і суглобів, при ендокардиті та абсцесі мозку). На сьогодні метицилін не рекомендований до використання в клінічній практиці, оскільки у 2–10 % хворих викликає інтерстиціальний нефрит. Оксацилін, не поступаючись в антимікробній активності метициліну, краще переноситься, але при внутрішньому застосуванні відмічається невисока його концентрація в крові, через що препарат слід призначати парентерально, а для перорального застосування краще використовувати клоксацилін або диклоксацилін.
Однією з найбільш поширених груп пеніцилінів у нашій країни залишаються амінопеніциліни. Ампіцилін і амоксицилін характеризуються однаковим спектром антимікробної активності. При цьому ампіцилін існує у формах для парентерального і перорального застосування, амоксицилін вводиться лише внутрішньо. Ампіцилін погано всмоктується при призначенні per os (біодоступність складає 20–40 %), через що в крові створюються не зовсім адекватні концентрації, окрім цього на абсорбцію препарату може суттєво впливати прийом їжі. Біодоступність амоксициліну становить 70–80 %, він краще всмоктується, незалежно від прийому їжі, створюючи в крові і тканинах вищі концентрації.
Амоксицилін є препаратом першого ряду в амбулаторній практиці при лікуванні гострих інфекцій ЛОР органів, нижніх дихальних шляхів (гострий бактеріальний бронхіт, позалікарняна бактеріальна пневмонія), сечовивідних шляхів, деяких інфекціях кишківника (черевний тиф, сальмонельоз), а також при стоматологічних втручаннях як профілактика бактеріального ендокардиту.
Амінопеніциліни недоцільно призначати при лікуванні хронічних або госпітальних інфекцій дихальних та сечовивідних шляхів, оскільки в цьому випадку спостерігається збільшення частоти стійких до цих препаратів штамів бактерій. У таких ситуаціях доцільніше використовувати комбіновані препарати амінопеніцилінів з інгібіторами бета-лактамаз — амоксиклав, ампіцилін+сульбактам.
Антисиньогнійні пеніциліни. Залежно від хімічної структури виділяють карбоксипеніциліни (карбеніцилін, тикарцилін) і уреїдопеніциліни (піперацилін, азлоцилін, мезлоцилін). Антимікробна активність карбоксипеніцилінів і уреїдопеніцилінів однакова, за винятком Кlebsiela spp. Ці пеніциліни активні щодо P. Aeruginosa. За дією на синьогнійну паличку дані препарати можна розмістити таким чином: азлоцилін = піперацилін > мезлоцилін = тикарцилін > карбеніцилін. Показанням до їх призначення є тяжкі госпітальні інфекції різноманітної локалізації (дихальних, сечовивідних шляхів, інтраабдомінальні, гінекологічні), викликані чутливими мікроорганізмами. Найбільш часто ці препарати в комбінації з аміноглікозидами та фторхінолонами призначаються при лікуванні інфекцій, викликаних P. aeruginosa, а також при підозрі на синьогнійну інфекцію і при змішаній аеробно-анаеробній інфекції.
Антисиньогнійні пеніциліни не слід призначати у вигляді монотерапії через можливий швидкий розвиток стійких штамів. При введенні їх не можна змішувати в розчині з аміноглікозидами.
Необхідно пам’ятати, що всі ін’єкційні форми цих препаратів містять натрій. При призначенні великих доз карбеніциліну відбувається значне надходження натрію до організму та збільшення ризику розвитку гіпокаліємії, що слід враховувати у хворих із хронічною серцевою і нирковою недостатністю. Схильність до кровотеч обумовлена розвитком дисфункції мембран тромбоцитів і частіше спостерігається при застосуванні карбоксипеніцилінів. При лікуванні пацієнтів з нирковою недостатністю або перед операціями перевагу слід надавати уреїдопеніцилінам, а не карбоксипеніцилінам, через ризик розвитку геморагічних ускладнень.
За частотою застосування цефалоспорини посідають одне з перших місць серед усіх антимікробних препаратів. Популярність цих антибіотиків пояснюється такими чинниками: широким спектром антимікробної дії (за винятком ентерококів, хламідій та мікоплазм); бактерицидним механізмом дії; стійкістю до бета-лактамаз стафілококів у препаратів I та II поколінь і грам(–) бактерій у препаратів III та IV поколінь; доброю переносимістю і невеликою частотою побічних проявів; простотою і зручністю дозування.
Класифікація цефалоспоринів заснована на їхньому спектрі антимікробної активності. В клінічній практиці найбільш часто застосовуються цефалоспорини I, II та III поколінь, а в останнє десятиріччя з’явилися препарати цефалоспоринів IV покоління (табл. 1).
Цефалоспорини I покоління активні переважно щодо грам(+) коків (стафілококи, стрептококи, пневмококи). Препарати руйнуються бета-лактамазами грам(–) бактерій, але стабільні до бета-лактамаз, що продукуються стафілококами. Ось чому застосування цефалоспоринів I покоління у клініці виправдане при доведеній або ймовірній стафілококовій інфекції (шкіри та м’яких тканин, кісток і суглобів, мастит, сепсис та ендокардит). У цьому випадку вони є альтернативними засобами пеніциліназостійким пеніцилінам (оксацилін тощо).