Реферат: Гідроліз
Наприклад, при додаванні до розчину хлориду сурми(III) дистильованої води спостерігається утворення осаду SbOCl, що свідчить про протікання реакції гідролізу солі SbCl3 по другій ступіні. Саме друга ступінь гідролізу хлориду сурми(III) приводить до утворення основної солі Sb(ВІН)2Сl, розкладання якої і дає осад хлориду оксосурьми.
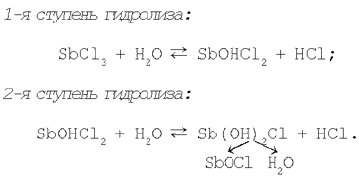
Таким чином, розбавляючи розчин, зміщаємо рівновага реакції гідролізу вправо.
Якщо гідроліз – явище небажане, то працювати потрібно з концентрованими розчинами при знижених температурах. Корисно також додати до розчину солі надлишок одного з продуктів, що утворяться при гідролізі, ( кислоти чи луги, у залежності від реакції середовища розчину), тим самим сприяючи зсуву хімічної рівноваги реакції уліво відповідно до принципу Ле Шателье.
Так, якщо до розчину з осадом Sbосl долити соляну кислоту, то осад розчиниться. Якщо потім знову в розчин додати воду, то спостерігається повторне утворення осаду.
Описані явища погодяться з раніше зробленими висновками про вплив розведення розчину на ступінь гідролізу, а також підтверджують оборотний характер процесу і можливість зсуву хімічної рівноваги реакції гідролізу.