Реферат: Температура. Рівняння теплового руху молекул
План
Температура, та її вимірювання.
Пояснення температури і тиску на основі молекулярних уявлень.
Енергія теплового руху молекул.
1. При контакті два по-різному нагрітих тіла обмінюються енергією внаслідок теплопередачі. Коли при цьому одне з них передає енергію другому, то вважають, що перше тіло має вищу температуру, ніж друге. Якщо під час контакту тіла не обмінюються енергією теплопередачею, то вони мають однакову температуру. В цьому випадку кажуть, що тіла перебувають у тепловій рівновазі.
Вважають, що два тіла А і В мають однакову температуру, якщо кожне з них знаходиться в тепловій рівновазі з тілом.
Тіло С називають термометром. Отже, термометр – це тіло, яке перебуває у тепловому контакті з іншим, температуру якого вимірюють. Після встановлення між ними теплової рівноваги можна твердити, що виміряна температура дорівнює температурі термометра.
При зміні теплового стану тіла змінюються й інші його фізичні властивості (об’єм, електричний опір тощо). За зміною будь-якої з них можна судити про підвищення чи зниження температури тіла. Історично склалося так, що температуру почали вимірювати за зміною об’єму та під час нагрівання. Принцип побудови термометрів при цьому такий.
Приведемо тіло, вибране нами за “вимірювач” температури, в теплову рівновагу з танучим льодом. Припустимо, що його температура в цьому випадку дорівнює нулеві, і виміряємо об’єм тіла V. Потім приведемо його в теплову рівновагу з киплячою під атмосферним тиском водою і визначимо відповідний об’єм тіла V100. Нехай у цьому випадку температура тіла дорівнює 100 градусів. Таким чином, зміні температури на 100 градусів відповідає зміна об’єму на V100-V0. Вважаючи, що об’єм термометричного тіла змінюється з температурою лінійно, дістанемо, що V100 зміни об’єму, тобто відповідає зміна температури на один градус. Отже, за градус приймають одну соту різниці між температурами кипіння і замерзання чистої води при атмосферному тиску.
Встановлену таким чином температурну шкалу називають шкалою Цельсія на честь шведського астронома А.Цельсія, який запропонував її. Про градуйований в такий спосіб термометр можна застосувати для вимірювання температури, приводячи його в теплову рівновагу з тим тілом, температуру якого треба виміряти. Ртутними і спиртовими термометрами із шкалою Цельсія ми багато разів користувалися на уроках фізики, хімії, біології тощо, а також у повсякденному житті.
У фізиці широко поширеною є так звана абсолютна температурна шкала (шкала Кельвіна), в якій за температуру замерзання води прийнято 273,15 градуса, а кипіння 373,15 градуса. Розмір градуса цієї шкали такий самий, як і шкали Цельсія. Температуру, яку відраховують за абсолютною температурною шкалою, називають абсолютною і позначають літерою Т, а градус цієї шкали (градус Кельвіна) позначають літерою К на відміну від градуса Цельсія (оС). Між абсолютною температурою Т і температурою за Цельсієм t існує таке співвідношення: Т=t+273. Температуру ОК називають абсолютним нулем, за шкалою Цельсія йому відповідає – 273,15оС.
2. Температура тіла і швидкість руху його молекул тісно пов’язані між собою. Чим вища температура тіла, тим швидше рухаються його молекули, тим більша їхня кінетична енергія. Таким чином, кінетичну енергію молекул, як і температуру, можна розглядати як міру їхнього теплового руху.
Молекула ідеального газу, що рухається зі швидкістю υ1 має кінетичну енергію . Сума кінетичних енергій всіх молекул газу є загальною кінетичною енергією. Якщо всі молекули однакові, то
Розділимо загальну кінетичну енергію Ek молекул на кількість молекул:
Величину називають середньою кінетичною енергією Ek поступального руху молекули.
Останню формулу можна записати так:
Величину υ² називають середнім значенням квадрата швидкості.
Якщо привести два гази з різними значеннями середньої кінетичної енергії молекулі зіткнення, через певний час їхні середні кінетичні енергії молекул стануть однаковими, оскільки стикаючись одна з одною, молекули обох газів обмінюються енергією. При цьому відбувається передача енергії від газу з більшим значенням середньої кінетичної енергії до газу з меншим значенням цієї величини. Після вирівнювання середніх кінетичних енергій молекул в газах настає теплова рівновага, при якій припиняється передача енергії від одного газу до іншого, хоча зіткнення молекул, які хаотично рухаються, продовжуються.
Але, як відомо, аналогічно ведуть себе тіла, які мають неоднакову температуру. При їх зіткненні енергія передається теж від одного з них до іншого доти, поки не стануть однаковими їхні температури, тобто поки не встановиться між тілами теплова рівновага. Вищою вважається температура тіла, яка віддає енергію.
З цього співставлення випливає, що середня кінетична енергія поступального руху молекул змінюється так само, як і температура. Під час зіткнення тіл обидві ці величини вирівнюються, тобто встановлюється теплова рівновага тіл.
Природно припустити, що температура може служити мірою середньої кінетичної енергії молекул газу. В цьому можна переконатися і на досліді.
Дослід Штерна дає можливість вивчити дуже важливу залежність швидкості руху молекул від температури. Змінюючи силу струму в дротині із якої відбувається випаровування молекул, змінюють тим самим температуру і, вимірюючи середню швидкість молекул, встановлюють залежність швидкості молекул від температури.
Середня кінетична молекул Ek пропорційна абсолютній температурі газу Т. У випадку ідеального газу зв’язок між цими величинами виражається формулою
Коефіцієнт k називають сталою Больцтмана. Він показує, наскільки зміниться кінетична енергія однієї молекули при зміні температури на один градус. Числове значення сталої Больцмана можна знайти лише експериментально k=1,38 · 10-23Дж/К.
Температура – це міра середньої кінетичної енергії руху молекул. Цей висновок справедливий не тільки для ідеального газу, а й для речовини в будь-якому стані. Абсолютним нулем температури є температура, при якій середня кінетична енергія поступального руху молекул дорівнює нулю.
Доведено, що навіть при абсолютному нулі молекулярний рух не припиняється – молекули здійснюють коливальні рухи. Однак ні при якому експерименті дістати абсолютний нуль температури неможливо. Тим більше не можна дістати температуру, нижчу за абсолютний нуль, оскільки кінетична енергія завжди додатня величина. Зараз вдалося досягти температур лише на 1,2 · 10-6К вищих за абсолютний нуль.
Температура – це макроскопічна величина, яка характеризує стан величезної к-ті молекул. Не можна говорити про “температуру” однієї або кількох молекул, про “гарячі” і “холодні” молекули. Зокрема, немає смислу говорити про температуру газу в космічному просторі, де число молекул в одиниці об’єму таке мале, що вони не утворюють газ в звичайному розумінні цього слова.
Частинки газу, які рухаються хаотично з великими швидкостями, увесь час “бомбардують” стінки оболонки, в якій він знаходитсья, - посудини. Ударяючись в стінку, молекула надає їй імпульс, що дорівнює зміні власного імпульсу. Оскільки молекул дуже багато і ударяють вони в стінку дуже часто, можна замінити їхню сумарну дію на поверхню стінки однією безперервно діючою середньою силою. Значення цієї сили, що припадає на одиницю поверхні стінки, визначає тиск, який чинить газ на стінку посудини. Щоб визначити тиск газу, треба цю силу поділити на площу відповідної поверхні. Тиск газів – це результат співударів із стінкою великої кількості молекул. Оскільки молекули рухаються зовсім невпорядковано, а число їх в одиниці об’єму газу дуже велике, то відбувається в середньому однакова кількість ударів у будь-якому напрямі, тому тиск газу на всі стінки посудини має бути однаковим. Хаотичність руху є причиною того, що рівнодійна всіх сил ударів молекул, які діють на стінки посудини чи на будь-яку поверхню всередині газу, перпендикулярна до поверхні. Силу удару молекули можна розділити на дві складові: перпендикулярну до поверхні і паралельну їй. Хоча к-сть молекул величезна, завжди знайдеться інша частинка, яка має однакову за модулем і протилежно напрямлену складову силу удару, паралельну поверхні. Тому результуюча всіх цих складових дорівнює нулю. Тиск створюють складові сил ударів, перпендикулярних до поверхні.
Тиск газу – це величина, яка характеризує стан великої кількості молекул, тобто макроскопічна величина.
3. Щоб обчислити тиск газу на стінку посудини, слід визначити сумарну силу ударів його молекул об цю стінку і розділити її на площу стінки. Для цього розглянемо механізм зіткнення молекул з оточуючою газ оболонкою, вважаючи газ ідеальним.
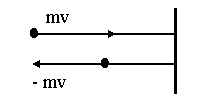 Нехай молекула масою m рухається зі швидкістю υ перпендикулярно до стінки. Її імпульс до удару об стінку дорівнює mυ. Оскільки газ ідеальний, удар молекули пружний, тобто вона не втрачає своєї швидкості, а лише змінює напрям
Нехай молекула масою m рухається зі швидкістю υ перпендикулярно до стінки. Її імпульс до удару об стінку дорівнює mυ. Оскільки газ ідеальний, удар молекули пружний, тобто вона не втрачає своєї швидкості, а лише змінює напрям
руху, тому її імпульс змінюється при ударі на
За третім законом Ньютона такий самий імпульс під час удару молекули дістає стінка. За другим законом Ньютона на неї діятиме сила
, де Δr1 – час удару.
Виділимо в порожнині з газом куб, ребро якого l. Припустимо, що в ньому знаходиться V молекул, маса кожної з них m. Щоб полегшити розв’язання поставленої задачі, введемо деякі спрощення щодо характеру руху молекул. Оскільки молекули рухаються хаотично, всі напрями їх руху в газі рівноцінні, і можна вважати, що частинки рухаються тільки вздовж трьох взаємно перпендикулярних напрямів. Якщо в посудині міститься N молекул, у будь-який момент часу вздовж кожного з цих напрямів одночасно рухатиметься 1/3 N молекул, причому половина з них, тобто 1/6 N, переміщається вздовж даного напряму в один бік, половина – в протилежний. Далі припустимо, що частина з них рухаються від однієї грані куба до іншої, не стикаючись між собою. Нехай всі молекули рухаються зі швидкістю υ. Простежимо за однією з них, яка летить від лівої стіни куба до правої і назад. Внаслідок удару молекула передає стінці імпульс 2mυ. Через певний час Δt вона знову вдаряється в ту саму стінку. Обчислимо час, який розділяє два послідовних удари молекул в одну і ту саму стінку. Між ударами молекула проходить шлях 2l зі швидкістю υ, значить, . За 1с кількість ударів цієї частинки об стінку