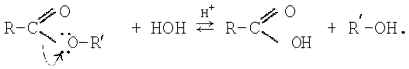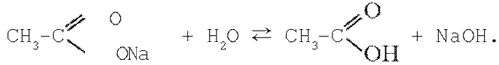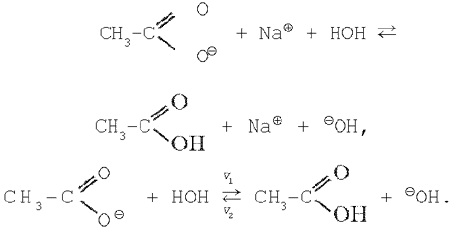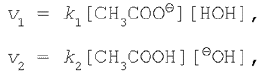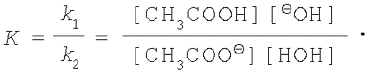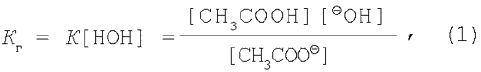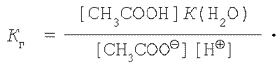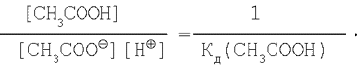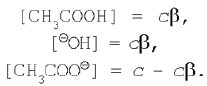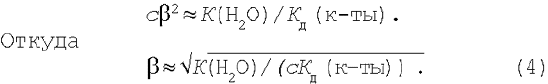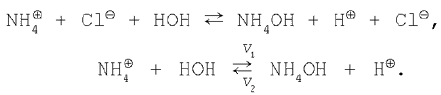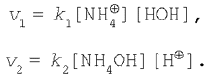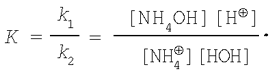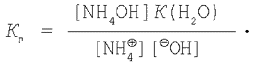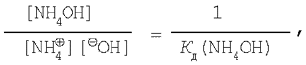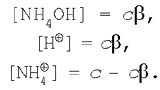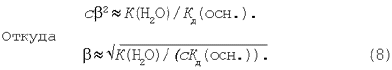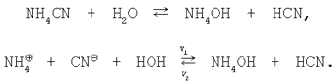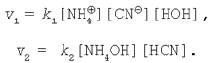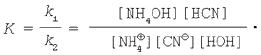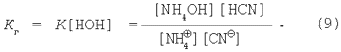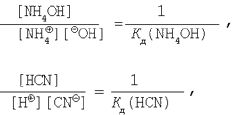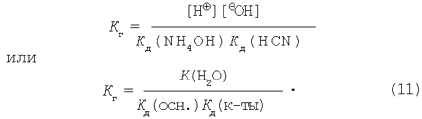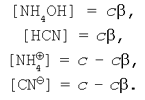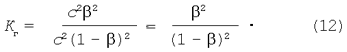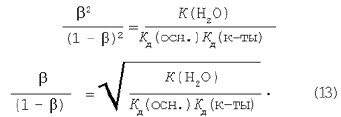Слово «гідроліз» буквально означає «розкладання водою». Гідролізом називається усяка взаємодія речовини з водою обмінного характеру, при якій складові частини речовини з'єднуються зі складовими частинами води. Наприклад, складні ефіри розкладаються водою з утворенням суміші кислоти і спирту: 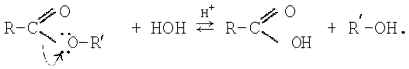
Хлорид фосфору(III) піддається гідролізу, утворити фосфористу і соляну кислоти: 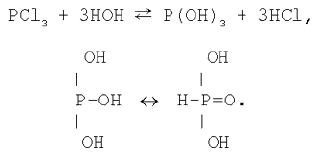
На практиці особливо часто приходиться мати справа з гідролізом солей. Природно припустити, що розчини середніх солей, що є продуктами повного заміщення протонів у молекулах кислот катіонами металу, повинні мати нейтральну реакцію середовища. Однак це припущення виявляється справедливим тільки у відношенні солей, утворених сильними кислотами і сильними основами. Солі, утворені слабкою кислотою і сильною чи основою, навпаки, сильною кислотою і слабкою основою, не дають при розчиненні у воді нейтральної реакції середовища. Наприклад, розчин хлориду заліза(III) дає кислу реакцію середовища, що вказує на присутність іонів водню (іонів гідроксонія); розчин карбонату натрію має лужне середовище, обумовлену присутністю в ньому гідроксид-іонів. Якщо сіль утворена слабкою кислотою і слабкою основою, то реакція розчину залежить від відносної сили, що утворяться в результаті гідролізу кислоти і основи. Наприклад, із двох слабких електролітів, що утворять ціанід амонію, менш слабким електролітом є гідроксид амонію, що підтверджується значеннями констант дисоціації: Кд(NH4OH)=1,79• 10–5; Кд(HCN) = 7,90• 10–10. Виходить, розчин ціаніду амонію буде слаболужним. Розчин ацетату амонію буде нейтральним, тому що константи дисоціації оцтової кислоти і гідроксиду амонію майже однакові: Кд(CH3COOH)=1,86• 10–5; Кд(NH4OH) = 1,79• 10–5. Ці явища можна пояснити взаємодією іонів розчиненої солі з диполями води, у результаті якого утвориться надлишок водневих іонів (іони гідроксонія) чи гідроксид-іонов. Оборотна реакція обміну між іонами розчиненої солі й іонами води, що приводить до утворення малодисоційованих часток ( молекули чи іони), зветься гідролізу солі. Кількісно гідроліз солей може бути охарактеризований ступенем гідролізу і константою гідролізу. Константа гідролізу і ступінь гідролізу 1. Сіль, утворена слабкою кислотою і сильною основою. Рівняння гідролізу солі ацетату натрію в молекулярній формі: 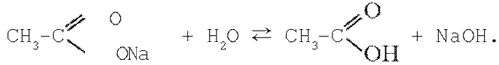
В іонній формі рівняння має вид: 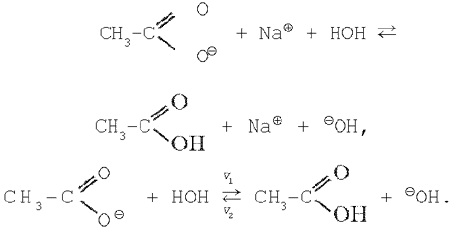
Застосовуючи до цього оборотного процесу закон діючих мас, запишемо вираження для швидкостей прямої і зворотної реакцій: 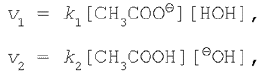
де k1 і k2 – константи швидкості прямої і зворотної реакцій відповідно. Як і будь-який інший оборотний процес, реакція гідролізу закінчується встановленням хімічної рівноваги, тобто такого стану системи, коли швидкості прямої і зворотної реакцій рівні: v1 = v2. Відкіля 
Константа хімічної рівноваги До дорівнює відношенню константи швидкості прямої реакції до константи швидкості зворотної реакції. Таким чином, 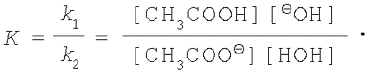
Концентрацію води в розчині допускається вважати величиною постійної, тому об'єднаємо [НОН] і К. 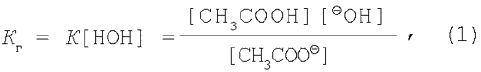
де Кг – константа гідролізу. Відомо, що 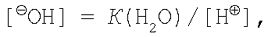
де ДО(H2O) – іонний добуток води. Підставляючи вираження для  в рівняння константи гідролізу (1), одержимо: в рівняння константи гідролізу (1), одержимо: 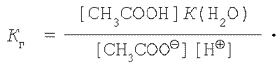
Однак 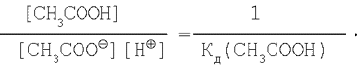
Тоді остаточно маємо: 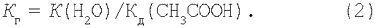
Ступенем гідролізу називається відношення кількості гідролізованої солі до загальної кількості розчиненої солі. Визначимо ступінь гідролізу солі, утвореним слабкою кислотою і сильною основою. Нехай у реакції гідролізу солі ацетату натрію початкова концентрація її, а виходить, і ацетатів-іонів (тому що сіль – сильний електроліт) дорівнює с. Тоді рівноважні концентрації приймуть значення: 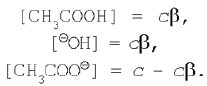
Відобразимо ці вираження в рівняння константи гідролізу (1): 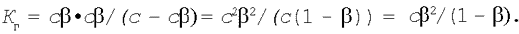
Скориставшись рівнянням (2), одержимо: 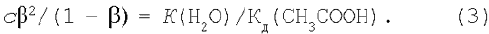
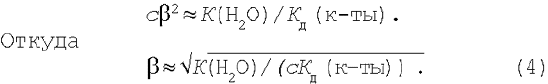
2. Сіль, утворена сильною кислотою і слабкою основою. Рівняння гідролізу солі хлориду амонію в молекулярній формі: 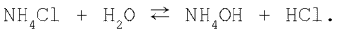
В іонній формі рівняння має вид: 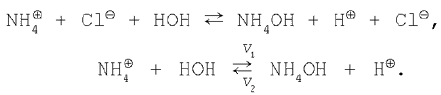
Застосовуючи закон діючих мас, запишемо: 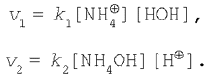
У стані хімічної рівноваги v1=v2, тому 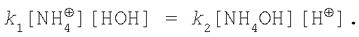
Відкіля 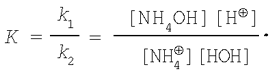
Поєднуючи [НОН] і ДО, одержимо: 
Відомо, що 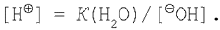 Підставимо це вираження в рівняння (5) і одержимо: 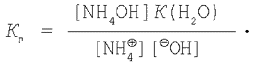
Знаючи, що 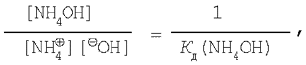
маємо остаточне вираження: 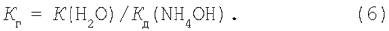
Виведемо рівняння для ступеня гідролізу солі, утвореної слабкою основою і сильною кислотою. Нехай у реакції гідролізу солі хлориду амонію її початкова концентрація, а виходить, і концентрація катіонів амонію (тому що сіль – сильний електроліт) дорівнює с. Тоді рівноважні концентрації придбають значення: 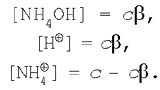
Підставимо ці вираження в рівняння для константи гідролізу (5): 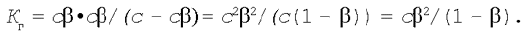
Скориставшись рівнянням (6), одержимо: 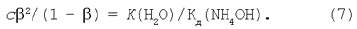
Перетворимо рівняння (7): 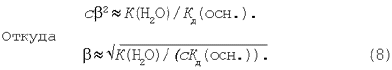
3. Сіль, утворена слабкою кислотою і слабкою основою. Рівняння гідролізу солі ціаніду амонію в молекулярній і іонній формах: 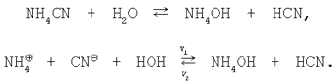
Застосуємо закон діючих мас до даного оборотного процесу: 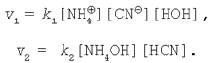
У стані хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції: 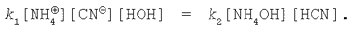
Константа хімічної рівноваги – це відношення константи швидкості прямої реакції до константи швидкості зворотної реакції: 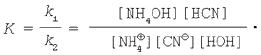
Як і в попередніх випадках, об'єднаємо K і [НОН]: 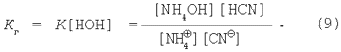
Помножимо чисельник і знаменник у рівнянні (9) на величину іонного добутку води: 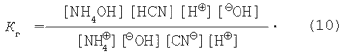
Знаючи, що 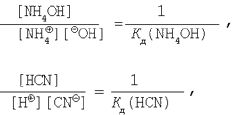
перетворимо вираження для константи гідролізу (10). У результаті одержимо: 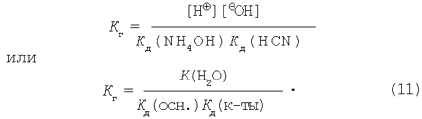
Виразимо ступінь гідролізу солі, утвореним слабкою кислотою і слабкою основою. Нехай вихідна концентрація солі ціаніду амонію в реакції гідролізу дорівнює с. Вихідні концентрації катіона амонію і ціаніду-аніона також можна вважати рівними з (пам'ятаючи, що сіль – сильний електроліт). Тоді рівноважні концентрації приймуть значення: 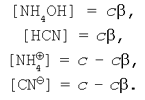
Підставляючи вираження рівноважних концентрацій у рівняння константи гідролізу (9) одержимо: 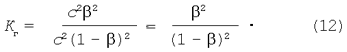
Дорівнюємо праві частини рівнянь (11) і (12): 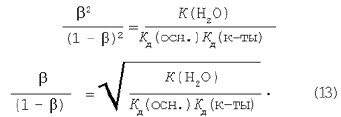
З рівнянь (4), (8), (13) випливає, що ступінь гідролізу тим більше: чим більше величина ДО(H2O), тобто чим вище температура, тому що іонний добуток води зростає з підвищенням температури; чим менше константи дисоціації Кд електролітів, що утворять сіль, тобто чим слабкіше електроліти, залишки яких входять до складу солі; чим менше концентрація солі в розчині, тобто чим більше ступінь розведення розчину (висновок випливає з рівнянь (4) і (8)).
|